Ciência e Saúde
Anvisa autoriza uso emergencial de dois kits para detecção da Monkeypox no Brasil
Ambos são produzidos pela Bio-Manguinhos/Fiocruz
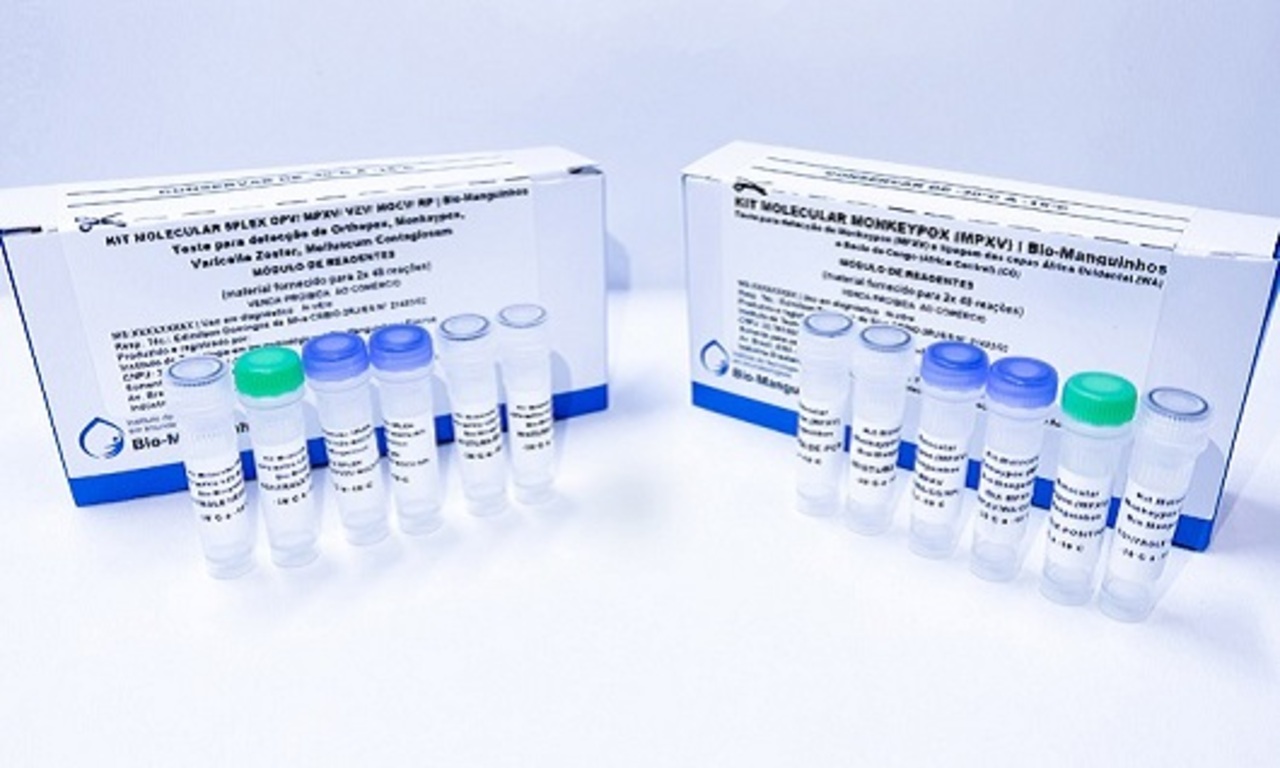
Na última semana, a Agência Nacional de Vigilância Sanitária (Anvisa) anunciou a autorização para uso emergencial de dois kits para detecção da Monkeypox no Brasil, ambos produzidos pela Bio-Manguinhos/Fundação Oswaldo Cruz (Fiocruz). Os itens são reagentes para diagnóstico da doença que estavam em análise de aprovação de registro pela Anvisa. Ao todo, 24 mil kits foram autorizados para utilização no País, sendo que a aprovação levou em conta a atual situação epidemiológica da Monkeypox no Brasil.
Segundo a Anvisa, os testes aprovados foram o Kit Molecular Monkeypox – MPXV e o Kit Molecular 5Plex OPV/ MPXV/ VZV/ MOCV/ RP. “A autorização foi concedida após solicitação conjunta da Secretaria de Vigilância em Saúde, do Ministério da Saúde (SVS/MS) e do Instituto Bio-Manguinhos/Fiocruz, para autorização excepcional de uso dos referidos kits moleculares, que não têm registro na Anvisa”, completa.
De acordo com a assessoria, a decisão ocorreu também devido à limitação da capacidade de resposta laboratorial à Monkeypox, bem como devido “a declarada necessidade de descentralização do diagnóstico para toda a Rede Nacional de Laboratórios de Saúde Pública (RNLSP); a quantidade de exames represados aguardando análise; o risco associado à demora de diagnósticos, no que se refere à propagação da doença no país; a distribuição dos testes para os Laboratórios Centrais de Saúde Pública (Lacens); o fato de não existirem testes comerciais ou kits para diagnóstico de monkeypox registrados na Anvisa”, completa.
Além disso, a decisão foi motivada pela “dificuldade logística e de padronização de metodologias in house e do alto custo para realização do sequenciamento genético; as estratégias de monitoramento e de garantia da qualidade dos testes apresentadas pelo Ministério da Saúde; a necessidade de cumprimento dos requisitos dispostos na RDC 302/2005 para execução de metodologias in house; e o posicionamento das áreas técnicas da Agência e de especialistas de notório saber sobre o tema”, explica a Anvisa.
“Destaca-se que, atualmente, no país, estão estruturados tecnicamente oito laboratórios de referência para o diagnóstico da monkeypox, por biologia molecular, que têm demonstrado limitação na capacidade de atender à crescente demanda, gerando um quantitativo de solicitações de exames represadas. Com o pedido de uso emergencial dos dois kits, o Ministério da Saúde pretende descentralizar a realização do diagnóstico da monkeypox para a Rede de Laboratórios Centrais de Saúde Pública (Lacen) e propiciar o diagnóstico mais oportuno, com a redução do tempo de liberação do resultado ao paciente”, ressalta a Agência.
Não há testes que possam ser comercializados
De acordo com a Anvisa, até agora não existe no Brasil nenhum teste de diagnóstico da Monkeypox comercial com registro aprovado na Anvisa. “Portanto, atualmente, os protocolos que têm sido utilizados no país para diagnóstico de monkeypox, tanto nos laboratórios públicos como nos privados, têm sido baseados em metodologias próprias desenvolvidas pelos laboratórios clínicos, chamadas metodologias in house. Essa prática é reconhecida e regulamentada pela Anvisa por meio da Resolução (RDC) 302/2005”, informa.
“A Anvisa reforça que o acesso a exames laboratoriais oportunos e precisos de amostras de casos sob investigação é uma parte essencial do diagnóstico e vigilância desta infecção emergente, que busca mitigar a disseminação do vírus e contribuir com a avaliação adequada dos critérios de elegibilidade para acesso a medicamentos e vacinas para o combate à doença”, explica a assessoria.
De acordo com a assessoria, a Anvisa se mantém vigilante e alerta com relação às medidas sanitárias e regulatórias em torno do enfrentamento à emergência em saúde que decorre da Monkeypox. O objetivo, segundo a assessoria, é “contribuir com as ações necessárias à proteção da saúde da população, favorecendo o acesso a ferramentas para diagnóstico, tratamento e profilaxia, além de contribuir com a disseminação de medidas não farmacológicas”, finaliza.
Com informações da Anvisa

























