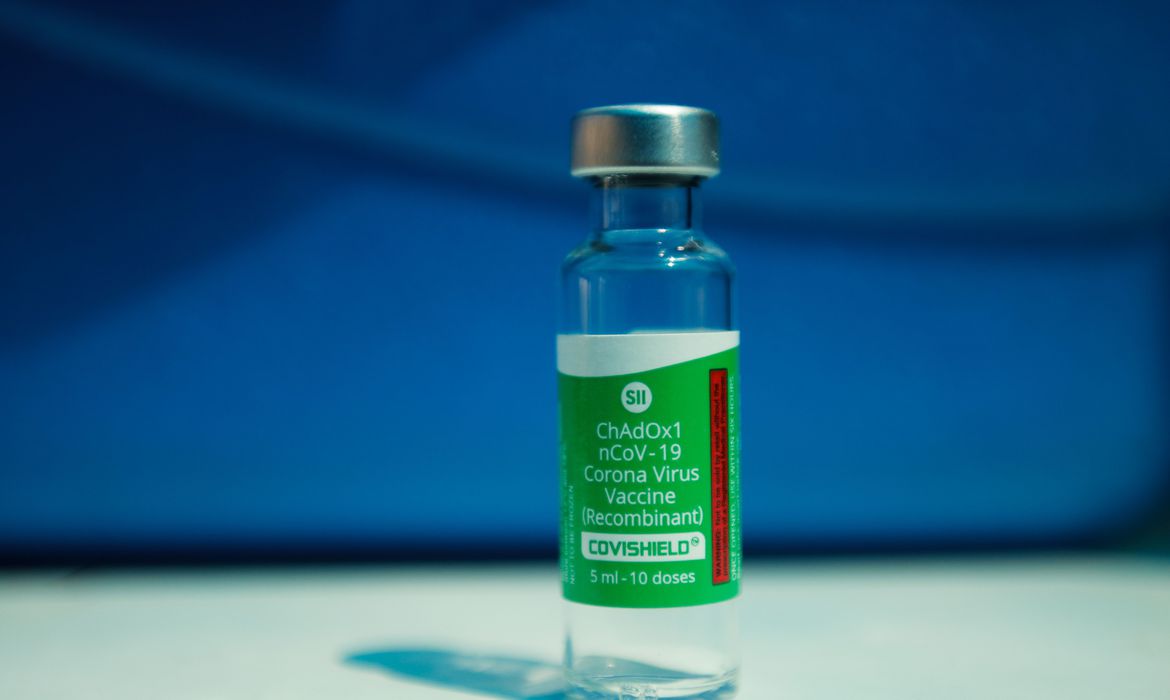
A Agência Nacional de Vigilância Sanitária (Anvisa) recomendou a continuidade do uso da vacina Covishield pela população brasileira. O imunizante é desenvolvido pela empresa AstraZeneca em parceria com a Universidade de Oxford. Em atualização do seu comunicado sobre o monitoramento de eventos adversos relacionados ao uso do imunizante, a Anvisa concluiu que “os dados não apontam alteração no equilíbrio benefício‐risco da vacina”.
De acordo com o órgão, a conclusão foi reforçada após a realização de uma reunião entre a Anvisa e autoridades regulatórias de vários países e também com a Sociedade Brasileira de Angiologia e Cirurgia Vascular. “Nas bases nacionais que reúnem os eventos ocorridos com vacinas não há registros de embolismo e trombose que tenham relação de causa com as vacinas contra a Covid-19.”, diz o comunicado.
Recentemente, alguns países da Europa decidiram suspender o uso da vacina diante do registro de problemas vasculares em pacientes. De acordo com a Agência de Saúde Europeia, foram reportados casos de múltiplas tromboses e embolia pulmonar em duas pessoas na Áustria e um caso de coágulo no sangue na Dinamarca, em que a pessoa morreu. A entidade afirmou que estudos preliminares não indicam que a causa dessas reações seja a vacina e já está revisando todos os casos relatados.
No Brasil, a Anvisa destacou que o lote que deu início às suspensões feitas na Europa, o ABV5300, não é utilizado no Brasil e que as doses aplicadas até agora da vacina Oxford/AztraZeneca vêm de um lote do Instituto Serum, da Índia, que também produz o imunizante.
A reunião com as agências internacionais foi feita no âmbito da Coalizão Internacional de Agências Reguladoras, que reúne 52 representantes de outras agências como a americana, canadense, japonesa, australiana, britânica, irlandesa, dinamarquesa, singapurense, entre outras. “A discussão técnica apontou para a necessidade de apresentação de outros dados e o aprofundamento das investigações nos países que invocaram o princípio da precaução para suspender o uso da vacina Oxford/AstraZeneca”, explicou a Anvisa.
Na quarta-feira, 17, a Fundação Oswaldo Cruz (Fiocruz), que tem parceria com a farmacêutica AstraZeneca, começa a entrega do primeiro lote de vacinas produzidas no Brasil. A previsão é que sejam entregues um total de 3,8 milhões de doses da Covishield até o final de março, que serão distribuídas pelo Ministério da Saúde de acordo com os critérios do Programa Nacional de Imunizações (PNI).
Fonte: Agência Brasil
Leia também: Sesa registra morte de macaco por febre amarela na divisa com o litoral